MÉTODOS DE SEPARACIÓN DE MEZCLAS HETEROGÉNEAS
Los procedimientos físicos más empleados para separar los componentes de una mezcla heterogénea son: la filtración, la decantación y la separación magnética. Estos métodos de separación son bastante sencillos por el hecho de que en estas mezclas se distinguen muy bien los componentes.
- Filtración: Este procedimiento se emplea para separar un líquido de un sólido insoluble. Ejemplo: Separación de agua con arena. A través de materiales porosos como el papel filtro, algodón o arena se puede separar un sólido que se encuentra suspendido en un líquido. Estos materiales permiten solamente el paso del líquido reteniendo el sólido.
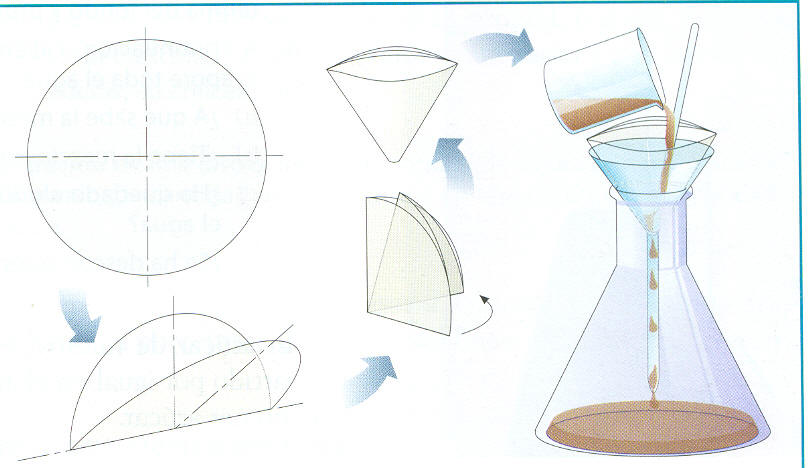 |  |
- Decantación: Esta técnica se emplea para separar 2 líquidos no miscibles entre sí. Ejemplo: Agua y aceite. La decantación se basa en la diferencia de densidad entre los dos componentes, que hace que dejados en reposo, ambos se separen hasta situarse el más denso en la parte inferior del envase que los contiene. De esta forma, podemos vaciar el contenido por arriba (si queremos tomar el componente menos denso) o por abajo (si queremos tomar el más denso).
En la separación de dos líquidos no miscibles, como el agua y el aceite, se utiliza un embudo de decantación que consiste en un recipiente transparente provisto de una llave en su parte inferior. Al abrir la llave, pasa primero el líquido de mayor densidad y cuando éste se ha agotado se impide el paso del otro líquido cerrando la llave. La superficie de separación entre ambos líquidos se observa en el tubo estrecho de goteo.
 |  |  |  |

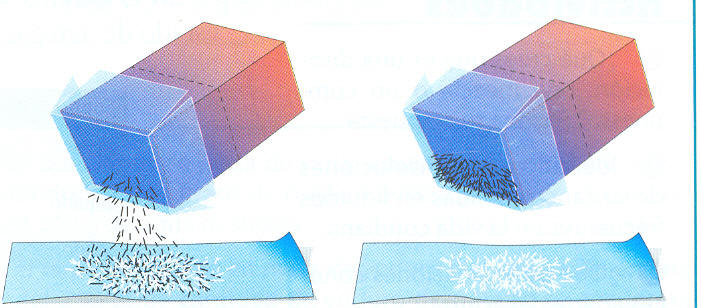
- Separación magnética: Esta técnica sirve para separar sustancias magnéticas de otras que no lo son. Al aproximar a la mezcla el imán, éste atrae a las limaduras de hierro, que se separan así del resto de la mezcla.
 |  |
Una disolución es una mezcla homogénea formada por 2 ó más sustancias puras en proporción variable. Las disoluciones pueden ser binarias (2 componentes), ternarias (3 componentes), etc. Ejemplo: Una mezcla de agua con sal es una disolución.
El componente de la disolución que se encuentra en mayor cantidad se llama disolvente y el o los que aparecen en menor cantidad se llaman solutos. Ejemplo: En una disolución de sal en agua, la sal es el soluto y el agua es el disolvente.
Las disoluciones binarias se clasifican según el estado de agregación en que se encuentran soluto y disolvente. en el siguiente cuadro podemos verlo:
| SOLUTO | DISOLVENTE | DISOLUCIÓN | EJEMPLO |
| GAS | GAS | GAS | AIRE  |
| LÍQUIDO | NIEBLA  | ||
| SÓLIDO | POLVO EN EL AIRE  | ||
| GAS | LÍQUIDO | LÍQUIDO | AMONIACO COMERCIAL  |
| LÍQUIDO | ALCOHOL Y AGUA  | ||
| SÓLIDO | SAL Y AGUA  | ||
| GAS | SÓLIDO | SÓLIDO | HIDRÓGENO EN PALADIO  |
| LÍQUIDO | AMALGAMAS (MERCURIO Y METAL)  | ||
| SÓLIDO | ACERO INOXIDABLE  |
No hay comentarios:
Publicar un comentario